Библиотека
Теология
Конфессии
Иностранные языки
Другие проекты
|
Комментарии (3)
Карпенков С. Концепции современного естествознания: Учебник для вузов
Глава 6 ЭВОЛЮЦИЯ ЕСТЕСТВЕННО-НАУЧНЫХ ЗНАНИЙ О ВЕЩЕСТВЕ
6.1. Развитие химических знаний
История развития знаний о веществе
Естествознание как наука о явлениях и законах природы включает одну из важнейших отраслей – химию. В современном понимании химия – наука о превращениях веществ, сопровождающихся изменением их состава и (или) строения. Химические процессы, лежащие в основе получения металлов, крашения тканей, выделки кожи и др., использовались человечеством уже на заре его культурной жизни.
История развития химических знаний начинается с древних времен. Древнегреческие философы Демокрит (ок. 470 или 460 г. до н. э. – умер в глубокой старости) и его последователь Эпикур (341–270 до н. э.) – основоположники античной атомистики – высказали идею: все тела состоят из неделимых материальных частиц – атомов, различающихся формой и величиной. Натурфилософскому атомистическому учению о строении вещества противопоставлялась алхимия – донаучное направление в развитии химии, возникшее в III–IV вв. н. э. и получившее развитие в Западной Европе в XI–XVI вв. Основная цель алхимии – нахождение так называемого «философского камня» для превращения неблагородных металлов в золото и серебро, получения эликсира долголетия и т. д. В эпоху Возрождения результаты химических исследований все в большей степени стали использоваться в металлургии, стеклоделии, производстве керамики, красок.
Первое научное определение химического элемента в 1661 г. сформулировал английский химик и физик Р. Бойль (1627–1691 гг.), положивший начало экспериментальному химическому анализу. В современном представлении химический элемент – совокупность атомов с одинаковым зарядом ядра. Основываясь на результатах своих экспериментов, Р. Бойль сделал важный вывод: качества и свойства вещества зависят от того, из каких химических элементов оно состоит. Возникшее таким образом учение о составе вещества развивается и сегодня на качественно новом уровне.
Принято считать, что химия стала подлинной наукой во второй половине XVIII в., когда первый российский ученый-естествоиспытатель, гениальный ученый М.В. Ломоносов (1711–1765) сформулировал принцип сохранения материи и движения и исключил из числа химических агентов флогистон – невесомую материю. Первая химическая теория – теория флогистона, согласно которой металлы железо, медь, свинец и др. считались сложными телами, состоящими из соответствующих элементов и универсального «невесомого тела» – флогистона, оказалась ошибочной. Выяснив роль кислорода в процессе горения, окисления и дыхания, французский химик А.Л. Лавуазье (1743– 1794) окончательно опроверг теорию флогистона.
В начале XIX в. английский химик и физик Дж. Дальтон (1766–1844) заложил основы химической атомистики. Он впервые ввел понятие «атомный вес» и определил атомные массы (веса) ряда элементов. Он установил в 1803 г. важный закон – закон кратных отношений: если два химических элемента образуют друг с другом более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся, как целые числа, обычно небольшие.
В 1811 г. итальянский физик и химик А. Авогадро (1776–1856) ввел понятие «молекула» и выдвинул молекулярную гипотезу строения вещества. Молекула – микрочастица, образованная из атомов и способная к самостоятельному существованию. Атомно-молекулярные представления утвердились лишь в 60-х годах XIX в. В те годы, а именно в 1861 г., выдающийся русский химик A.M. Бутлеров (1828–1886) создал и обосновал теорию химического строения вещества, согласно которой свойства веществ определяются порядком связей атомов в молекулах и их взаимным влиянием. Немного позднее – в 1869 г.– другой выдающийся русский химик– Д.И. Менделеев (1834– 1907) открыл периодический закон химических элементов – один из фундаментальных законов естествознания. Современная формулировка данного закона такова: свойства элементов находятся в периодической зависимости от заряда их атомных ядер. Заряд ядра равен атомному (порядковому) номеру элементов в периодической системе Менделеева. С конца XIX в. важнейшим направлением химии стало изучение закономерностей химических процессов. Управление химическими процессами – одна из главных проблем современной химии.
По мере развития химических знаний отдельные области химии – неорганическая химия, органическая химия, физическая химия, аналитическая химия – стали вполне самостоятельными отраслями естествознания. На стыке химии и других отраслей естествознания возникли, например, биохимия, агрохимия, геохимия. На законах химии базируются химические технологии, металлургия и т. п.
В последние десятилетия благодаря открытию новых явлений и эффектов, прежде всего физических, и созданию на их основе высокочувствительных приборов, электронных микроскопов, спектроскопов, масс-спектрометров и др. появилась реальная возможность проводить экспериментальные химические исследования на более высоком уровне – молекулярном. Такие исследования позволили раскрыть механизм многих процессов в живом организме, синтезировать не существующие в природе вещества с необычными свойствами, установить сложную структуру молекулы ДНК, расшифровать молекулярный генный механизм наследственности и благодаря применению современной лазерной техники и высокочувствительных приборов удалось зарегистрировать быстропротекающие химические процессы, возможность протекания которых раньше даже не предполагалась.
Молекулярный уровень современного естествознания позволяет создавать не только сверхпрочные, сверхпроводящие и другие материалы с необычными свойствами, но и производить операции с фрагментами молекулы ДНК, изменяя ее генетический код. Сегодня уже говорят о конструировании устройств из отдельных молекул, о создании молекулярного компьютера, обладающего чрезвычайно большими возможностями.
Масштабы химической индустрии
Долгое время необходимые человеку товары повседневного спроса (продукты питания, одежда, краски) производились путем переработки преимущественно природного сырья растительного происхождения. Современные химические технологии позволяют синтезировать из сырья не только естественного, но и искусственного происхождения многочисленную и многообразную по своим свойствам продукцию, не уступающую природным аналогам. Потенциальные возможности химических превращений природных веществ поистине безграничны. Все возрастающие потоки природного сырья: нефти, газа, угля, минеральных солей, силикатов, руды и т.п. – превращаются в краски, лаки, мыло, минеральные удобрения, моторное топливо, пластмассы, искусственные волокна, средства защиты растений, биологически активные вещества, лекарства и различное исходное сырье для производства других необходимых и ценных веществ.
Темпы научно-технических разработок химических технологий быстро растут. Если в середине XIX в. на промышленное освоение электрохимического процесса получения алюминия потребовалось 35 лет, то в 50-е годы XX в. крупномасштабное производство полиэтилена при низком давлении было налажено менее чем за 4 года. На крупных предприятиях развитых стран примерно 25% оборотных средств расходуется на научно-исследовательские работы, разработку новых технологий и материалов, что позволяет примерно через 10 лет существенно обновлять ассортимент выпускаемой продукции. Во многих странах промышленные предприятия выпускают около 50% продукции, которая 20 лет назад вообще не производилась. На некоторых передовых предприятиях ее доля достигает 75–80%.
Разработка новых химических веществ – трудоемкий и дорогостоящий процесс. Например, для нахождения и синтеза всего лишь нескольких лекарственных препаратов, пригодных для промышленного производства, необходимо изготовить не менее 4000 разновидностей веществ. Для средств защиты растений данная цифра может достигать и 10000. В недалеком прошлом в США на каждый внедряемый в массовое производство химический продукт приходилось примерно 450 научно-исследовательских разработок, из которых отбиралось всего лишь 98 для опытного производства. После опытно-промышленных испытаний лишь не более 50% отобранных продуктов находили широкое практическое применение. Однако практическая значимость полученных таким сложным путем продуктов настолько велика, что затраты на исследования и разработку очень быстро окупаются.
Благодаря успешному взаимодействию химиков, физиков, математиков, биологов, инженеров и других специалистов появляются новые разработки, обеспечивающие в последнее десятилетие внушительный рост производства химической продукции, о чем свидетельствуют следующие цифры. Если общий выпуск продукции в мире за 10 лет (1950–1960) увеличился примерно в 3 раза, то объем химической продукции за этот же период возрос в 20 раз. За десятилетний период (1961– 1970гг.) средний годовой прирост промышленной продукции в мире составлял 6,7%, а химической – 9,7%. В 70-е годы прирост химической продукции, составляющий около 7%, обеспечил ее увеличение примерно вдвое. Предполагается, что при таких темпах роста к концу нынешнего столетия химическая промышленность займет первое место по выпуску продукции.

Химические технологии и связанное с ними промышленное производство охватывают все важнейшие сферы народного хозяйства, включающего различные отрасли экономики. Взаимодействие химических технологий и различных сфер деятельности людей условно представлено на рис. 6.1, где введены обозначения: А – химическая и текстильная промышленность, целлюлозно-бумажная и легкая промышленность, производство стекла и керамики, производство различных материалов, строительство, горное дело, металлургия; Б – машино- и приборостроение, электроника и электротехника, средства связи, военное дело, сельское и лесное хозяйство, пищевая промышленность, охрана окружающей среды, здравоохранение, домашнее хозяйство, средства информации; В – повышение производительности труда, экономия материалов, успехи в здравоохранении; Г – улучшение условий труда и быта, рационализация умственного труда; Д – здоровье, питание, одежда, отдых; Е – жилища, культура, воспитание, образование, охрана окружающей среды, оборона.
Приведем несколько примеров применения химических технологий. Для производства современных компьютеров нужны интегральные схемы, технология изготовления которых основана на использовании кремния. Однако в природе нет кремния в химически чистом виде. Зато в больших количествах есть диоксид кремния в виде песка. Химические технологии позволяют обычный песок превратить в элементный кремний. Еще один характерный пример. Автомобильный транспорт сжигает громадное количество топлива. Что нужно сделать, чтобы добиться минимального загрязнения атмосферы выхлопными газами? Частично такая проблема решается с помощью автомобильного каталитического конвертора выхлопных газов. Радикальное же ее решение обеспечивается применением химических технологий, а именно химическими манипуляциями над исходным сырьем – сырой нефтью, перерабатываемой в очищенные продукты, эффективно сгораемые в двигателях автомобилей.
Значительная часть населения земного шара прямо или косвенно связана с химическими технологиями. Так, к концу 80-х годов XX в. только в одной стране – США – в химической индустрии и родственных отраслях было занято более 1 млн. человек, в том числе свыше 150000 ученых и инженеров-технологов. В те годы в США продавали химической продукции примерно на 175–180 млрд. долл. в год.
Химические технологии и связанная с ними индустрия вынуждены реагировать на стремление общества сохранить окружающую среду. В зависимости от политической атмосферы такое стремление может колебаться от разумной осторожности до паники. В любом случае экономическое следствие – рост цен на продукцию, обусловленный затратами на достижение желаемой цели сохранения окружающей среды, на обеспечение безопасности рабочего персонала, на доказательства безвредности и эффективности новых продуктов и т. п. Разумеется, все эти затраты оплачивает потребитель и они существенно отражаются на конкурентоспособности выпускаемой продукции.
Представляют интерес некоторые цифры, касающиеся выпускаемой и потребляемой продукции. В начале 70-х годов XX в. средний горожанин использовал в повседневной жизни 300–500 разнообразных химических продуктов, из них около 60 – в виде текстильных изделий, примерно 200 – в быту, на рабочем месте и во время отдыха, примерно 50 медикаментов и столько же продуктов питания и средств приготовления пищи. Технология изготовления некоторых пищевых продуктов включает до 200 различных химических процессов.
Около десяти лет назад насчитывалось более 1 млн. разновидностей продукции, выпускаемой химической промышленностью. К тому времени общее число известных химических соединений составляло более 8 млн., в том числе примерно 60 тыс. неорганических соединений. Сегодня известно более 18 млн. химических соединений. Во всех лабораториях нашей планеты ежедневно синтезируется 200–250 новых химических соединений. Синтез новых веществ зависит от совершенства химических технологий и в значительной степени от эффективности управления химическими превращениями.
Успехи в развитии современной химии во многом определяются степенью управления химическими превращениями, которые непосредственно зависят от химической реакционной активности реагентов. Повышению степени управления химическими процессами способствует внедрение новых экспериментальных методов химических превращений с применением современных технических средств контроля и анализа сложных молекулярных структур.
В упрощенном понимании химию можно представить как науку о превращениях одного набора химических веществ в другой. Такое превращение (химическая реакция) на молекулярном уровне означает перегруппировку одного набора молекул в другой. Химическая реакция начинается со смешивания реагентов и заканчивается образованием конечных продуктов. В большинстве случаев она включает ряд промежуточных стадий, и для полного понимания механизма реакции нужны сведения о промежуточных молекулах, образующихся на каждой стадии, протекающей, как правило, очень быстро. Если 20–30 лет назад технические средства эксперимента позволяли проследить за промежуточными молекулами с временем жизни около одной миллионной доли секунды, то современные лазерные источники излучения существенно расширили временной диапазон исследований от 10-6 до 10-15 с. Сейчас физики умеют получать лазерные импульсы длительностью менее 5 фемтосекунд (1 фс = 10-15) и уже приближаются к аттосекундам (1 ас = 10-18 с). За основополагающие работы в области фемтохимии американец египетского происхождения Ахмед Зивейл удостоен Нобелевской премии по химии 1999 г. Свои первые экспериментальные исследования сверхбыстрых реакций, инициируемых лазерным импульсом феттосекундной длительности, он начал в конце 80-х годов с изучения распада молекул цианида йода.
Электромагнитное излучение играет важную роль не только в детальном исследовании промежуточных процессов химических превращений, но и в их инициировании. Например, видимое или ультрафиолетовое излучение, поглощаемое некоторыми молекулами, сообщает им энергию, достаточную для изменения распределения электронной плотности, ослабления химических связей и возникновения новой молекулярной структуры, которую трудно получить в реакциях даже при термическом или другом воздействии.
Приобретенная при поглощении молекулой энергия может высвободиться в виде излучения света, цвет которого часто отличается от цвета поглощенного света. Если излучение происходит быстро – в течение 10-9–10-12 с, то оно называется флуоресценцией. Голубой свет, испускаемый бунзеновской газовой горелкой, и северное сияние – это примеры флуоресценции. При медленном процессе излучения света, длящимся от нескольких миллисекунд до нескольких секунд или минут, происходит фосфоресценция (голубое свечение вечером приливов и отливов, свечение циферблатов некоторых марок часов и т.п.).
Применение современной лазерной техники позволяет изучать возбужденное состояние молекул. На определенной длине волны света генерируются строго определенные возбужденные состояния, и при относительно небольшой длительности импульсов можно определить длительность очень быстрых химических процессов, происходящих при флуоресценции. Проанализировав спектр излучаемого света, можно определить скорость таких процессов и распределение энергии в молекулах. Таким образом можно воспроизвести картину электронных состояний молекул.
Лазерное излучение для изучения электронных состояний молекул применялось, например, при облучении бензофенона. Раствор бензофенона при воздействии ультрафиолетового излучения с длиной волны 316 нм испускает свет с двумя длинами волн – 410 и 450 нм, т.е. происходит вторичное излучение с разными длинами волн. Если длительность импульса лазерного излучения равна 10 пс, то на меньшей длине волны – 410 нм вторичное излучение носит характер флуоресценции, а на большей длине волны, соответствующей 450 нм, наблюдается фосфоресценция. Данные наблюдения дают представление о возбужденных состояниях бензофенона и скорости перехода между ними, что весьма важно для понимания сущности природного фотосинтеза – основополагающего процесса растительного мира, воспроизведение которого – давняя мечта ученых-естествоиспытателей.
При смешивании двух газообразных соединений образование продуктов реакции определяется статистической вероятностью, зависящей от энергетического состояния исходных соединений, типов возбуждения и взаимной ориентации молекул при столкновении. Сталкиваются молекулы не только реагирующих соединений, но и каждого из них. Современная вакуумная техника открывает новые возможности для взаимодействия реагирующих соединений при столкновении молекул. В глубоком вакууме, когда длина свободного пробега молекул велика, столкновение молекул может происходить в сравнительно небольшом объеме, составляющем зону пересечения двух молекулярных пучков реагирующих соединений. Молекулярные пучки образуются при пропускании газообразного вещества через узкое сопло, формирующее поток молекул в вакуумной камере со сверхвысоким вакуумом. При пересечении молекулярных пучков возрастает вероятность участия каждой молекулы не более чем в одном столкновении, приводящем к реакции. Это означает, что появляется реальная возможность для изучения тонких деталей химического превращения при единичных столкновениях молекул, что представляется весьма важным средством управления химическими процессами.
Определение характеристик атомных и молекулярных частиц (их структуры и состава) в аналитической химии называют качественным анализом, а измерение их относительного содержания – количественным анализом. Новые методы качественного и количественного анализа основываются на важнейших достижениях различных отраслей естествознания и, в первую очередь, физики. Методы аналитической химии широко применяются во многих отраслях химии, в медицине, сельском хозяйстве, в геологии, экологии и т. п.
Многие методы количественного анализа можно реализовать только после разделения исследуемой сложной смеси на составляющие ее компоненты. Один из универсальных методов разделения – хроматография. Сущность данного метода заключается в том, что различные вещества в жидкой или газообразной фазе обладают разной прочностью связи с поверхностью, с которой они находятся в контакте. С помощью жидкостной хроматографии можно разделить и зафиксировать чрезвычайно малое количество вещества в смеси, составляющее lO-12 г. Хромотографический метод позволяет разделить газообразные смеси, содержащие тысячи компонентов, а также разделить вещества, отличающиеся только изотопным составом.
Для анализа и идентификации структуры сложных молекул, объединяющих большое количество атомов с различными взаимными связями, широко применяются основанные на физических принципах экспериментальные методы ядерного магнитного резонанса, оптической спектроскопии, масс-спектроскопии, рентгеноструктурного анализа, нейтронографии и т. п.
6.3. Синтез химических веществ
Синтез органических и неорганических соединений
В последние десятилетия активизировались исследования на стыке смежных отраслей естествознания – химии металлоорганических и бионеорганических соединений, химии твердого тела, биогеохимии и др. Неорганические элементы и соединения, последнего времени, играют важную роль в живых системах. Живые системы нельзя считать полностью чисто органическими. Они весьма чувствительны к ионам металлов почти всей периодической системы элементов Менделеева. Некоторые ионы принимают участие в таких жизненно важных процессах, как связывание и транспорт кислорода (железо в гемоглобине), поглощение и конверсия солнечной энергии (магний в хлорофилле, марганец в фотосистеме, железо в ферродоксине, медь во фталоцианине), обмен электрическими импульсами между клетками (кальций, калий в нервных клетках), мышечное сокращение (кальций), ферментативный катализ (кобальт в витамине В12) и др.
Важнейший предмет изучения быстро развивающейся неорганической химии биосистем – строение ближайшего и дальнего окружения атомов металлов и его изменение под воздействием кислотных агентов, давления кислорода и других факторов.
Быстро развивается еще одна отрасль – химия элементоорганических соединений. Для исследования сложнейших структур и связей таких соединений применяются новейшие методы спектроскопии и рентгеноструктурного анализа, позволившие открыть большое семейство соединений со сложной структурой. Пример таких соединений – синтезированный ферроцен – вещество, атомы железа которого расположены между двумя плоскими кольцами.
Химики-металлоорганики стремятся создать новые катализаторы для фиксации азота, т. е. для превращения молекулярного азота N2 в аммиак NH3 – исходный продукт для производства удобрений. Одно из важных достижений – синтез соединений, способных избирательно взаимодействовать с теми молекулами, которые долгое время считались слишком инертными для химических превращений, но представляли и представляют практический интерес. Например, насыщенные углеводороды относительно инертны, не содержат двойных или тройных углерод-углеродных связей. Недавно синтезированы соединения родия и иридия, содержащие фосфины (PR3), или карбинилы, и другие соединения, которые способны расщеплять связи С–Н в метане и циклопропане. При сочетании такой важной реакции синтеза с другими видами превращений можно наладить массовое производство насыщенных углеводородов – ценнейшего промышленного сырья. Таким способом можно осуществить прямое превращение метана в метанол – метиловый спирт – важнейшее сырье для производства многих химических веществ.
С участием металлоорганических соединений осуществляются важные промежуточные стадии многих органических реакций. Данные соединения богаты электронами, поэтому в природе они играют роль посредника во многих процессах переноса электронов.
Сравнительно новая отрасль химической науки – химия композиционных структур – позволила синтезировать из двух или более веществ композиты, свойства которых превосходят свойства каждого из них. Например, синтезированы и производятся неметаллические проводники из чередующихся слоев, многослойная керамика для соединения полупроводниковых схем. Другой интересный новый класс материалов – композиты на сверхтонких волокнах. Тонкие волокна толщиной 50–100 нм (тоньше человеческого волоса) существенно изменяют свойства вещества, в котором они равномерно распределены. Одна из главных задач химии композитов – изучение взаимодействия компонентов в таких сложных композиционных системах.
Селективный и фотохимический синтез
Одна из важнейших задач органической химии – достижение селективности, которая соответствует строго определенным структурным изменениям в молекуле. Для решения такой довольно трудной задачи нужно изучить реакционную способность реагентов для каждого типа связи – хемоселективность, создать при взаимодействии реагентов их правильную ориентацию – региоселективность и заданную периодическую пространственную конфигурацию – стереоселективность. Например, синтез адамантана С10Н14 дает представление о том, как можно контролировать все данные факторы. С10Н14 – уникальная молекула, представляющая собой фрагмент структуры алмаза, содержащей 10 углеродных атомов. Впервые адамантан удалось получить путем очень трудоемкого многостадийного синтеза с выходом только 2,4%. Благодаря последним экспериментальным исследованиям адамантан синтезируется в одну стадию и с выходом 75%.
Широкое распространение получила реакция циклоприсоединения с образованием пятичленных циклов, применяющихся для синтеза самых различных соединений – от новых электропроводящих материалов до лекарственных препаратов, например, антибиотиков и противоопухолевых средств. Так, замыкание цикла на радиевом катализаторе является ключевой стадией в синтезе тиенамицина, в котором пятичленный цикл содержит атом азота. Конечный продукт оказался эффективным, подобным пенициллину, средством против инфекционных болезней.
Фотохимический синтез основан на действии излучения. После поглощения энергии молекула переходит в возбужденное энергетическое состояние. Химические свойства молекулы существенно зависят от свойств поглощенного света, при котором например, константа диссоциации кислот изменяет на 5–10%, окислительные и восстановительные процессы активизируются и даже химически инертные вещества могут стать реакционноспособными.
В результате фотохимического синтеза получены многие биологически активные соединения, например, алкалоид атизин, несколько антибиотиков, провитамин D и др. Активность фотохимического синтеза в значительной степени зависит от длины волны возбуждающего света и температуры. Так, при уменьшении длины волны всего лишь на 1% – с 302,5 до 300,0 нм – выход провитамина Дз увеличивается вдвое, а при снижении температуры синтеза до 21°С – вчетверо.
Биосинтез
Среди природных веществ есть регуляторы роста растений и насекомых, органические соединения, используемые насекомыми в качестве средств коммуникации, пестициды, антибиотики, витамины и многие целебные вещества. Природное соединение сначала необходимо обнаружить, затем выделить его химическим путем, потом определить его структуру и свойства и, наконец, произвести заданный синтез.
Часто химики стремятся получить только одну нужную форму из двух, являющихся зеркальным отражением друг друга. Каждый атом углерода, с которым связаны различные группы атомов, порождает пару симметричных зеркальных структур и называется хиральным атомом или хиральным центром. Характерный пример выделения только одной зеркальной формы – синтез антибиотиков. В природе встречается около 50 соединений подобного типа, среди них самое известное – монензин, продуцируемый штаммом бактерий. Антибиотики такого типа (монензин, лазалоцид, салиномицин) широко применяются для борьбы с инфекционными заболеваниями в бройлерном производстве. В США ежегодно продают примерно на 50 млн. долл. монензина. Монензин включает 26 атомов углерода, 17 хиральных центров, что означает возможность существования 217 различных стереоизомеров. Поэтому для осуществления синтеза монензина необходимы высокостереоселективные реакции. Производство монензина и его структурных аналогов – крупное достижение современного биосинтеза.
Важным средством экспериментального изучения биосинтеза стало применение изотопных меток для обычных элементов, таких как изотопы углерода 13С и 14С, водорода 2Н и ЗH, азота 15N и кислорода 17О. Природный изотоп в определенном положении молекулы реагента замещают на изотопную метку, и после реакции определяют место расположения данной метки в молекуле продукта реакции. Для чего применяется метод спектроскопии ядерного магнитного резонанса. Такой метод позволил определить схему биосинтеза сильных ядов, вырабатываемых грибами, которые поражают зерно и другие продовольственные товары.
При исследовании строения биополимеров – гигантских молекул белков и нуклеиновых кислот, синтезируемых живыми организмами, возникают те же проблемы, что и при изучении природных соединений с меньшей молекулярной массой. Белки выполняют различные биологические функции: участие в пищеварении, транспорт кислорода в крови, сокращение мышечных волокон, защита от вирусов и бактерий с помощью антител и т. п. Сложная пространственная форма белков во многом определяет их биологические функции. Так, молекула коллагена – белка, придающего прочность коже и костям, – имеет форму стержня. Антитела представляют собой молекулы с выемками Y-образной формы, которые заполняются молекулами чужеродных веществ и служат для запуска реакций, обеспечивающих их эффективное обезвреживание.
Белки – высокодинамические системы, которые при осуществлении биологических функций способны менять форму. Например, свет вызывает изменение формы родопсина – белка сетчатки глаза, что и является первичной стадией зрительного восприятия. Такое изменение происходит в течение менее одной миллиардной доли секунды. Подобные процессы в молекулах белков обнаруживаются с помощью импульсных лазеров.
Общие сведения
Катализ – ускорение химической реакции в присутствии веществ – катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав конечных продуктов. Благодаря катализу повышается скорость реакций даже при небольших температурах, активизируется образование только определенных продуктов из ряда возможных. Катализ – основа многих химико-технологических процессов, например, производства серной кислоты, некоторых полимеров, аммиака и др. Большинство превращений, происходящих в живых организмах, также являются каталитическими (ферментативными).
Хорошо известна реакция между кислородом и водородом, приводящая к образованию воды:
2H2 + O2 → 2H2O
Смесь двух объемов газообразного водорода и одного объема кислорода, называемая гремучим газом, способна реагировать со взрывом и выделением, большого количества тепла. Однако реакция протекает настолько медленно, что даже после продолжительной выдержки данной смеси вряд ли удастся обнаружить хоть какое-нибудь количество воды. Скорость реакции существенно повышается при нагревании реакционной смеси или при воздействии на нее электромагнитного излучения. Аналогичное действие оказывает и введение катализатора, который помогает преодолеть энергетический барьер, препятствующий началу реакции.
Некоторые промышленные химические процессы проводятся в газовой форме при наличии твердых катализаторов. Однако на практике чаще всего осуществляются жидкофазные каталитические процессы. В последние десятилетия не менее 20% всей промышленной химической продукции производят каталитическим способом.
К довольно эффективным катализаторам относятся ионообменные смолы, металлоорганические соединения, мембранные катализаторы. Каталитическим свойством обладают многие химические элементы периодической системы Менделеева, среди которых важнейшую роль играют металлы платиновой группы и редкоземельные металлы.
Некоторые катализаторы позволяют уменьшить в химических превращениях не только температуру, но и давление. Например, разработанный в нашей стране катализатор дал возможность синтезировать метанол при давлении 50 атм. и температуре 260–290° С, в то время как раньше такой синтез проводился при давлении до 1000 атм. и температуре 300–400° С.
Ряд катализаторов существенно ускоряет химические реакции. С участием катализатора скорость некоторых реакций увеличивается в 10 млрд. раз. Селективные катализаторы оказывают такое же сильное влияние, но лишь на одну из многих конкурирующих реакций. Стереоселективные катализаторы позволяют не просто контролировать состав конечного продукта, но и способствуют образованию молекул определенной формы и зачастую сильно влияют на физические свойства продукта, такие как прочность, твердость, пластичность, а также на активность биологических объектов.
Каталитические процессы можно классифицировать с учетом их физической и химической природы. Различают несколько основных видов катализа: гетерогенный и гомогенный, электрокатализ, фотокатализ и ферментативный катализ. В гетерогенном катализе химическая реакция происходит в поверхностных слоях на границе раздела твердого тела и газообразной или жидкой смеси реагентов. При гомогенном катализе исходные реагенты находятся в одной фазе (газовой или жидкой). В электрокатализе реакция протекает на поверхности электрода в контакте с раствором и под действием электрического тока. В нем в отличие от гетерогенного катализа возможно управление химическим процессом при изменении электрического тока. При фотокатализе химическая реакция стимулируется энергией поглощенного излучения, и она может происходить на поверхности твердого тела (в том числе и на поверхности электрода) или в жидком растворе. Процесс с участием ферментов называется ферментативным катализом. Ему присущи свойства как гетерогенного, так и гомогенного катализа. Ферменты – это большие белковые структуры, способные удерживать молекулы реагента в ждущем состоянии до начала реакции. Фермент, кроме того, собирает подходящее химическое окружение, катализирующее нужную реакцию по прибытии партнера.
Гетерогенный катализ
Одна из важных задач гетерогенного катализа – увеличение эффективной поверхности катализатора. Удельная поверхность катализаторов, применяемых в промышленности, составляют около 150 м2/г. Некоторые катализаторы на основе активированного угля или молекулярных сит имеют удельную поверхность до 1000 м2/г. Кроме большой активной поверхности, катализаторы должны иметь небольшую массу, высокую прочность и обтекаемость. Совокупностью таких свойств обладают перспективные катализаторы – искусственные цеолиты (молекулярные сита) и пористая керамика.
Гетерогенный катализ известен давно – еще со времен шведского химика И.Я. Берцелиуса (1799–1848), но только недавно – примерно 20 лет назад – уникальные методы и приборы открыли путь для экспериментального исследования химических явлений на поверхности. В результате гетерогенного катализа получается из элементных азота и водорода аммиак NH3 – важнейший компонент удобрений. При повышенной температуре N2 и Н2 могут реагировать с образованием NH3 на совершенных кристаллах железного катализатора. Грань кристалла железа (111) примерно в 430 раз активнее, чем грань (110) и в 13 раз активнее, чем грань (100). Синтез аммиака – один из первых каталитических процессов, внедренный в крупное промышленное производство. Обычно катализатором для такого синтеза служат мелкие частицы железа – тонко-дисперсное железо, осажденное на оксиде алюминия с добавкой оксида калия. Синтез происходит при 500° С. В последнее время проводится поиск катализатора, который позволил бы снизить температуру синтеза.
К настоящему времени освоены многие новые каталитические процессы для промышленного производства ценных продуктов (табл. 6.1).
Таблица 6.1.

Современные экспериментальные средства позволяют проследить за поведением атомов на поверхности твердого катализатора. Поверхностные атомы обладают способностью образовывать химические связи и влиять на химические свойства молекул. Поэтому поведение реагентов на поверхности твердого катализатора может резко отличаться от поведения тех же молекул в растворе или газовой фазе.
Одно из перспективных направлений повышения эффективности катализа заключается в разработке молекулярных cит – природных или синтетических материалов, содержащих алюминий, кремний и кислород (алюмосиликаты) и включающих мельчайшие пустоты и каналы, образующие пористую структуру. Попавшие внутрь пустот и каналов молекулы вступают в химическую реакцию, которая при обычных условиях возможна только при высокой температуре. Форма и размер внутренних полостей не только влияют на селекцию реагентов, но и ограничивают размер частиц конечного продукта, т.е. молекулярные сита – селективные катализаторы. Они применяются, например, для производства высокооктанового бензина в результате крекинга и для превращения полученного из древесины метанола в бензин.
Давно известно, что чрезвычайно малых размеров частицы, состоящие всего лишь из нескольких тысяч атомов, могут активно катализировать превращения углеводородов (производство топлив) и реакцию синтеза аммиака из азота (производство удобрений). Такие частицы обладают каталитическими свойствами, если они получены из металлов: кобальт, никель, родий, палладий и платина. Все эти металлы являются очень дорогостоящими, поэтому разработка более дешевых и широко доступных катализаторов представляет практический интерес.
Производству нужны такие катализаторы, которые позволили бы превращать имеющееся в изобилии и дешевое сырье в более ценные и полезные соединения, а именно превращать азот в нитраты (производство минеральных удобрений), уголь в углеводороды (производство топлива), соединения с одним атомом углерода – моноксид в диоксид углерода, метан и метанол в соединения с двумя атомами углерода – этилен, этан, уксусную кислоту и этиленгликоль (промышленное сырье).
Для сохранения окружающей среды нужны не только каталитические конверторы для очистки выхлопных газов автомобилей, но и эффективные катализаторы для удаления оксидов серы из заводских дымов, очистки воды и т. п.
Гомогенный катализ
Часто гомогенные катализаторы представляют собой сложные металлосодержащие молекулярные соединения, структура которых позволяет осуществить тонкую настройку реакционной способности реагентов и достичь высокой селективности. Один из крупномасштабных промышленных процессов с применением гомогенного катализа – это частичное окисление параксилола и превращение его в терефталевую кислоту (см. рис. 6.2). В таком процессе катализатором служат соли кобальта и марганца. Большая часть конечного продукта подвергается самополимеризации с этиленгликолем и используется для производства полиэфирных тканей, корда для шин, контейнеров для соды и многих других полезных изделий. В промышленном процессе производства уксусной кислоты из метанола и моноксида углерода роль катализатора выполняет дикарбонилдииодид родия, позволяющий получить около 99% целевого продукта.
В качестве промышленного сырья было бы весьма заманчиво использовать некоторые широко распространенные вещества, включая азот, моноксид и диоксид углерода и метан. Однако это относительно инертные вещества, и для их участия в реакции нужны эффективные катализаторы. Для такой цели весьма перспективно применение растворимых металло-органических соединений. Например, при помощи растворимых соединений молекулярного азота с оловом и молибденом удается осуществить синтез аммиака. Химические связи углерод–водород в соединениях типа метана и этана, нереакционных в обычных условиях, разрываются родий-, рений-, иридийорганическими комплексами, и тем самым повышается их реакционная способность.
Одно из направлений катализа связано с синтезом молекул, ядро которых состоит из нескольких химически связанных атомов металла. Из таких молекул формируются кластеры, размеры которых больше, чем молекул гомогенных катализаторов, но меньше, чем частиц металла, служащих гетерогенным катализатором. Во многих металлах – активных гетерогенных катализаторах,– а именно в таких, как родий, платина, осмий, рутений и иридий обнаруживается способность к образованию кластеров. Существует ряд кластеров, получивших название кубаны. Ядро молекул кубанов состоит из четырех атомов металла и четырех атомов серы, расположенных в вершинах куба. Структура кубаны получена для железа, никеля, вольфрама и других металлов. К кубанам относится, например, производное железа – ферродоксин, являющийся функциональной частью белков, катализирующих реакции с переносом электронов в биологических системах.
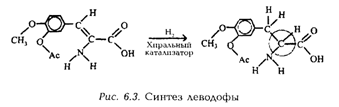
Многие биологические молекулы имеют одну из двух возможных геометрических структур, представляющих зеркальное отражение друг друга. Обычно лишь одна из таких хиральных структур биологически активна. Если сложная молекула содержит, например, семь хиральных углеродных атомов, а в процессе синтеза образуются все возможные хиральные структуры, то получится смесь 27 = 128 продуктов, из которых 127 могут быть неактивными или, еще хуже, давать нежелательные эффекты. Поэтому важно уметь синтезировать на каждом хиральном центре нужную структуру. Катализатор, обеспечивающий такой синтез, называется стереоселективным. В качестве примера можно привести синтез леводофы – соединения в виде стереоизомера аминокислоты (см. рис. 6.3). Молекула леводофы получается при стереоселективном присоединении водорода к двойной углерод-углеродной связи. Используемый при этом катализатор – растворимое соединение фосфина и родия – приводит к образованию конечного продукта с выходом 96%. Леводофа – эффективное средство лечения болезни Паркинсона.
Электрокатализ и фотокатализ
Благодаря химической модификации каталитически активных электродных поверхностей создается возможность управления химическими процессами, происходящими на границе раздела жидкий раствор – электроды. Химическая модификация электродов стимулирует вполне определенные реакции. Она осуществляется в результате технологической операции осаждения тонкопленочных слоев, широко применяемой для формирования рабочих элементов интегральных схем. Например, нанесенный тонкопленочный слой рутения в качестве каталитического покрытия существенно сокращает потребление энергии в производстве хлора и щелочи.
Электрохимическая ячейка может содержать один или два полупроводниковых электрода, поглощающих электромагнитное излучение. В результате возникает фотокатализ, стимулирующий окислительно-восстановительные процессы на границе раздела электрод– раствор. Подобный эффект наблюдается на границе раствор–частица. Фотокаталитические процессы представляют не только научный, но и практический интерес. Например, на поверхности диоксида титана происходит деструкция (разрушение структуры) токсичных веществ в стоках, в частности, в стоках цианидов. Известна идея фотокаталитического использования солнечной энергии для производства кислорода и водорода из воды. А водород как экологически чистое топливо (при его сгорании образуется вода) мог бы заменить истощающееся и загрязняющее атмосферу нефтяное топливо.
Искусственные ферменты
Ферменты – естественные биологические катализаторы, представляющие собой сложнейшие молекулярные системы. Современные экспериментальные средства позволяют не только определить состав подобного рода систем, но и управлять их молекулярной топологией, что очень важно при создании искусственных ферментов. Один из способов конструирования искусственных ферментов заключается в формировании в больших молекулах профилированных полостей с последующим их заполнением каталитическими связывающими центрами.
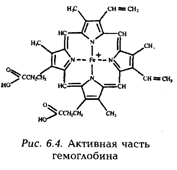
Искусственные ферменты иногда называют биоимитаторами. К настоящему времени получены биоимитаторы ферментов, биологически синтезирующих аминокислоты. Синтезированы ферменты, структурно родственные природному соединению – витамину В и обладающие высокой селективностью и даже стереоселективностью. Получены биоимитаторы нескольких ферментов, участвующих в переваривании белков, и соединения, катализирующие расщепление РНК, в которые введены каталитические группы, присутствующие в ферменте рибонуклеазе. Синтезирован имитатор гемоглобина – переносчик кислорода. Структура активной части гемоглобина изображена на рис. 6.4. Интенсивные работы по созданию искусственных ферментов продолжаются. В результате появляются новые биоимитаторы ферментов.
Геохимические процессы на Земле, происходящие в недрах Земли и на ее поверхности, представляют собой превращения сложных соединений и смесей, состоящих из кристаллических и аморфных фаз. Многие из них протекают при очень высоких давлениях и температурах. Современные технические средства эксперимента позволяют воспроизвести в лаборатории условия близкие к условиям внутри Земли и даже земного ядра. Природные процессы: кристаллизация, частичное растворение, изменение структуры минералов (метаморфизм), выветривание и т. п. – приводят к образованию рудных отложений или к их разрушению и рассеянию.
Большой интерес представляют метеориты: они дают необходимую информацию об эволюции небесных тел, находящихся на разных стадиях развития. При этом важную роль играет анализ изотопного состава многих металлов и газообразных веществ, найденных в метеоритах.
Химия внесла существенный вклад в исследование космического пространства они уже внесли и продолжают вносить. Без ракетного топлива и материалов, способных выдержать огромное давление, высокую температуру и интенсивное космическое излучение, без электрохимических источников энергии, без разнообразных химических средств для обеспечения питания космонавтов и устранения отходов мы сегодня смотрели бы на Луну из нашего прекрасного далека. Космос с давних пор стал объектом химических исследований. На стыке химии и астрофизики зародилась новая отрасль естествознания – космохимия, изучающая состав космических тел, законы распространенности элементов во Вселенной.
Первые результаты о химическом составе небесных тел были получены с помощью спектрального анализа. В химических лабораториях, кроме того, исследовался состав метеоритного вещества. Состав метеоритов оказался единообразным, как если бы они происходили из одного итого же рудника. До сих пор ни в одном метеорите не найден элемент, который не встречался бы на Земле. С помощью самых точных методов анализа в метеоритах обнаружены почти все известные на нашей планете элементы. Характерная особенность большинства метеоритов заключается в том, что они содержат много чистого железа и очень мало наиболее распространенного на Земле кварца. Вещества, которые указывали бы на существование жизни в космосе, пока не найдены, хотя углерод обнаружен в виде крошечных алмазов, графита и аморфного угля. Относительно недавно появилось сообщение об обнаружении бактериоподобной структуры в метеорите с Марса (см. рис. 6.5), что является предметом дальнейшей дискуссии о существовании жизни на данной планете в далеком прошлом.

Наиболее часто встречающиеся каменные метеориты, как и большинство земных пород, состоят в основном из силиката магния.
Железные метеориты содержат до 90% железа. Содержание никеля в них составляет 6–20%. Кроме того, метеориты содержат кобальт, медь, хром, фосфор, серу, платину, палладий, серебро, иридий, золото и другие элементы. Встречаются включения газов: водорода, оксида и диоксида углерода.
Прямая геологическая разведка небесных тел началась 21 июля 1969 г., когда люди впервые ступили на поверхность Луны и отобрали пробы лунного грунта. Через год с небольшим прилунилась первая автоматическая станция «Луна-16», возвратившаяся на Землю с образцами лунной породы. Немного позднее, в ноябре 1970 г. на Луну доставлена советская автоматическая станция «Луноход-1», которая, начав свое движение по Луне с северо-западного Моря дождей, обследовала за 321 сутки около 50 га лунной поверхности. Обследования проводились и днем, и ночью при температурах от –140 до + 130° С. Результаты анализа показали, что за исключением несколько повышенного содержания в них тугоплавких соединений титана, циркония, хрома и железа, лунные породы по своему составу очень похожи на земные. Некоторые различия выявились не в составе, а в свойствах. Так, например, лунное железо ржавеет медленнее, чем земное. В верхнем слое лунного грунта обнаружен удивительный минерал, получивший название реголит; теплопроводность которого значительно меньше теплопроводности лучших земных теплопроводных веществ.
Исследовались и другие космические объекты. Так, с помощью космического зонда, отправленного к Венере, в результате гамма-спектрального анализа установлено, что грунт Венеры по химическому составу соответствует граниту.
Материя, находящаяся в межзвездном пространстве, состоит из двух компонентов – межзвездного газа и межзвездной пыли. Наиболее распространены в космическом пространстве водород (70 масс. %) и гелий (28 масс. %). В газовых межзвездных облаках обнаружено более 20 химических компонентов. Наряду с простыми молекулами (СО, Н2, HCN, H2O, NH3) в 200 космических газовых скоплениях найдены и более сложные химические соединения – метанол, изоциановая кислота, формамид, формальдегид, метилацетилен и ацетальдегид. Относительно недавно обнаружены молекулы этилового спирта, муравьиной кислоты и других соединений.
Исследования космохимии носят преимущественно познавательный характер, но нельзя исключать, что в будущем они обретут практическую значимость. Тем не менее уже получены некоторые важные для практики результаты. Например, для химико-фармацевтической промышленности представляет практический интерес более интенсивное развитие бактериальных культур в невесомости, чем на Земле. Металлурги могут ожидать разработки сплавов с новыми свойствами. Весьма перспективно выращивание в космосе бездефектных монокристаллов, особенно оксидов металлов. Следует ожидать, что в XXI в. появится новая отрасль науки – химия синтеза в космосе.
Запасы и потребление сырья
Основная масса сырья для химической промышленности добывалась и добывается из недр земной коры. Доступная современным средствам массовой добычи толщина верхнего слоя земной коры составляет от 1 до 2 км. И в таком сравнительно тонком слое содержится не менее 20 000 блн т железа, 40 блн т меди, 48 блн т цинка, 7,2 блн т свинца и т. п. Почти 98,6 % поверхностного, физически доступного слоя земной коры составляет вещество, состоящее из всего лишь восьми химических элементов: кислород (47,0%), кремний (27,5%), алюминий (8,8%), железо (4,6%), кальций (3,6%), натрий (2,6%), калий (2,5%) и магний (2,1%). Среднее содержание химических элементов в земной коре хотя и абсолютно велико, но слишком мало для рентабельной повсеместной добычи ввиду их рассеянности. Рентабельны лишь месторождения, где сосредоточены существенные запасы тех или иных полезных ископаемых. Такие месторождения встречаются редко, и они неравномерно распределены по земному шару. Ни одна страна на планете не располагает всеми нужными видами сырья в достаточном количестве. В то же время на территории России находятся многие наиболее важные виды ценного природного сырья.
Многие промышленно развитые страны вынуждены ввозить сырье. Например, в США около 1/3 потребностей в марганце, хроме, кобальте, олове и 90% потребности в алюминиевом сырье удовлетворяются за счет импорта. Все большее количество свинца, цинка и вольфрама, железной руды и меди в этой стране также становится предметом импорта.
Запасы сырья, добываемых с помощью современных технических средств во всем мире, быстро исчерпываются. Ресурсы Земли хотя и очень велики, но ограничены, поэтому человеческое общество не сможет долго развиваться на основе традиционных методов добычи сырья. Химические элементы в природе, как они интенсивно бы не эксплуатировались, не уничтожаются, а переходят в другие соединения, мало пригодные для экономического оборота.
Решающую роль в сбережении природных ресурсов должны сыграть не только новые способы добычи, но и новейшие химические технологии, которые позволят применять более доступное и дешевое сырье с необычным элементным составом. Можно привести не один пример, когда новые химические технологии спасали от кризиса промышленное производство. Так было с производством стекла. Содовая технология, предложенная в 1789 г., направила в новое русло производство стекла во Франции, для которого применялось ранее калиевое сырье, вырабатываемое из древесины, что привело к почти полному истреблению лесных массивов во Франции.
Более 80% мировых сырьевых ресурсов и топлива потребляются в наше время только 1/3 частью населения Земли. Потребность в сырье очень быстро растет не только в развивающихся, но и в промышленно развитых странах. Такую возрастающую потребность могут удовлетворить:
· разработка новых месторождений, в том числе и морских шельфов, и добыча сырья, содержащегося в морской воде;
· освоение бедных месторождений;
· утилизация отходов;
· замена дефицитного сырья.
Весьма перспективен для добычи морской шельф, находящийся на глубине до 200 м. Подводные континенты, общая площадь которых чрезвычайно велика, в ближайшем будущем станут источником многих видов сырья.
Металлы
В недрах Земли содержится достаточно большое количество металлов, но их доля в тех соединениях, из которых они могут быть извлечены для промышленных целей, весьма ограничена. При современных масштабах добычи, по предварительным оценкам, основные запасы таких металлов, как свинец, медь, золото, цинк, олово, серебро и уран, уже в ближайшие десятилетия могут быть исчерпаны. В то же время железо, марганец, хром, никель, молибден, кобальт и алюминий будут добываться в достаточном количестве даже в середине XXI в.
Самое необходимое, важное и широко потребляемое из всего металлического сырья – железо – четвертый по распространенности в земной коре элемент. Его общие запасы составляют около 12 блн т. Надежно разведанные и используемые мировые запасы составляют только примерно 100 млрд. т. Наибольшими запасами железных руд располагают Россия ( примерно 40% всех руд), Австралия, Канада, США и Бразилия. В одной только Курской магнитной аномалии сосредоточено около 30 млрд. т железных руд, т. е. почти 1/3 мировых запасов.
Медь – второй по практической значимости металл. Ежегодная потребность меди – 50 млн. т. Если учесть, что запасы меди в известных месторождениях составляют 210–250 млн. т, а всего может быть добыто 1–2 млрд. т, то можно предположить, что в ближайшем будущем запасы меди будут исчерпаны. Около 37% месторождений меди находится в Чили.
Медь как электропроводящий материал может быть заменена легким металлом – алюминием, занимающем третье место по распространенности в земной коре. Хотя в целом запасы алюминия велики – около 8,8% массы земной коры, однако только 0,008% этой массы содержится в бокситах, мировые запасы которых оцениваются в 6 млрд. т. Примерно 1/3 таких запасов сосредоточена в Австралии. При ежегодном производстве алюминия 15–30 млн. т и темпах его роста до 9% запасов бокситов хватит надолго. Тем не менее в настоящее время разрабатываются методы промышленного извлечения алюминия из повсеместно распространенных и практически неисчерпаемых пород: глины, алюмосиликатов вулканических пород, содержащих до 10% алюминия.
Запасы другого важнейшего легкого металла – магния – достаточно велики – около 2,1% массы земной коры. С учетом сегодняшних потребностей запасов магния хватит на долгое время.
В обыденной жизни относительно редко встречаются такие металлы, как титан, неодим, литий, рубидий, европий, тантал и другие, но в природе они не так уж редки. Например, природные запасы рубидия примерно в 45 раз больше, чем свинца. Слово «редкий» часто означает, что тот или иной металл добывается в относительно небольших количествах, так как известны очень небольшие пригодные для рентабельной разработки его месторождения. Названные металлы – перспективные материалы для новой техники.
Титан – коррозионностойкий материал. Иногда его считают достойным соперником алюминия и стали. Применение титана в химической промышленности за последние десятилетия резко возросло. Тантал – необходимый компонент особо прочных кислото- и термостойких сплавов. Платина, палладий и родий широко применяются в качестве катализаторов. Существенная часть родия и палладия извлекается из радиоактивных отходов. Таким же способом можно получить теллур-99 – весьма ценный материал для производства сверхпроводников и предотвращения коррозии металлов и сплавов. Например, при весьма незначительной концентрации (до 0,1 мг/л) теллура железные изделия не ржавеют ни в водных, ни в солевых растворах даже при повышенной температуре.
Предполагается, что для добычи сырья некоторых металлов уже в ближайшем будущем существенно возрастет объем работ под водой – на морском шельфе. На глубине меньше 130 м находятся обогащенные морские отложения, содержащие благородные и тяжелые металлы: олово, золото, платину, железо, вольфрам, хром и др. Например, железные и марганцевые тихоокеанские конкреции содержат в среднем около 25% марганца и железа, а никель, медь, кобальт и титан в концентрациях составляют 1,5–3,5%. Общие запасы данных конкреций – более 1500 млрд. т, при ежегодном пополнении в 10 млн. т.
В морских водах Земли растворены около 4,5 млрд. т урана, примерно по 3 млрд. т марганца, ванадия и никеля, 6 млрд. т золота (около 1 т на каждого жителя планеты!). Однако концентрация их сравнительно мала. Тем не менее, если в будущем промышленное опреснение морской воды будет производиться в больших масштабах, то отходы солей, обогащенные в 3–4 раза, могут стать сырьем, вполне пригодным для извлечения содержащихся в нем металлов.
Неметаллическое сырье
Если металлы представляют практический интерес преимущественно в элементном состоянии, то неметаллы – сера, фосфор, азот, кислород, хлор и др. – ценны в образуемых ими соединениях. Несмотря на возрастающий спрос на различные химические продукты, огромные запасы неметаллического сырья вполне достаточны для обеспечения химической промышленности в течение относительно длительного периода времени.
Кроме элементной серы и серной руды – пирита (FeS2), широко применяемого для производства серы, многие содержащие серу минералы встречаются в больших количествах и во многих местах земной поверхности. К рентабельной можно отнести добычу и переработку гипса (CaSO4 · 2Н2О), ангидрита (CaSO4) и кизерита (MgSO4·H20). В перспективе баланс серы будет сохранен в результате переработки отходящих газов сернистых производств, количество серы в которых существенно превышает потребности промышленности.
Доступные для разработки современными средствами фосфорные месторождения содержат около 60 млрд. т фосфорного сырья Р2О5 . Около 2/3 промышленной фосфорной продукции приходится на страны бывшего СССР и США.
Один из важнейших видов неметаллического сырья – азот. Он входит в состав белков, широко применяется для производства удобрений и других промышленных продуктов. Хотя в земной коре доля азота сравнительно мала (около 0,03%) и его расходы относительно велики, проблема истощения вряд ли возникнет, поскольку окружающая нас атмосфера содержит около 78% азота.
Не менее важным химическим сырьем является кислород. Многие химические реакции – процессы окисления – протекают при прямом или косвенном участии этого элемента. Кислород – это самый распространенный элемент. Его доля в земной коре составляет приблизительно 47%. Однако значительная часть кислорода связана в виде различного рода оксидов, в том числе и продуктов сгорания. Атмосферный кислород составляет лишь около 0,013% общего количества. Этого достаточно для полного превращения в оксид углерода органической массы углерода, которая примерно в 1650 раз превосходит ныне существующую. Запасы кислорода постоянно обновляются благодаря процессам жизнедеятельности растений. Например, 1 га леса поставляет около 60 т кислорода в год. Кислород пополняется и при ультрафиолетовом расщеплении паров воды в атмосфере.
С увеличением объема производства соляной кислоты и винилхлорида потребность в следующем неметаллическом сырье – хлоре – постоянно возрастает. Запасы хлорного сырья вполне достаточны. Огромное количество хлора имеется в соляных залежах и в морской воде, 1 т которой содержит 30 кг соли NaCl.
Все большее практическое значение для развития общества приобретают искусственные строительные материалы: гипс, цемент, бетон и др. Необходимое для таких материалов сырье (песок, гравий, щебень, глина, галька, известняк, доломит) имеется в сравнительно больших количествах повсеместно. Проблема заключается не в количестве сырья, а в его территориальном расположении.
Для производства большинства химических продуктов требуется вода. Она служит растворителем, теплоносителем и исходным сырьем для получения кислорода и водорода. Химическая промышленность при 25%-ом общем потреблении воды промышленными предприятиями занимает второе место после энергетики.
Каковы же водные ресурсы нашей планеты? Океаны, моря, реки, озера и лед покрывают около 75% поверхности Земли. Если все количество воды, по некоторым оценкам составляющее 1386 млн. м3, равномерно распределить по поверхности земного шара, то толщина слоя воды окажется равной примерно 2700 м. На долю же пресной воды в такой водяной массе приходится всего 2,5%. Расходуется лишь небольшая часть пресной воды, совершающей непрерывный круговорот в природе. В то же время водные ресурсы неравномерно распределены, и часть их находится в непригодном для непосредственного потребления состоянии из-за большого содержания минеральных солей (что определяется природными условиями) и из-за высокой степени загрязнения. Поэтому водоснабжение населения сопряжено с проблемами транспортировки, очистки и сохранения чистоты природных вод.
Углерод
Углерод по распространенности в природе занимает тринадцатое место. На его долю приходится 0,087% массы земной коры, или 20 000 блн т, из которых около 99,5% содержится в карбонатных породах (карбонатах кальция и магния); 0,47% составляет диоксид углерода в атмосфере и в воде, 0,02% приходится на уголь, нефть и газ и 0,01% – на биосферу.
Рациональное использование запасов углерода возможно при выполнении следующих условий:
– химические технологии должны обеспечить синтез разнообразных необходимых соединений из любого имеющегося углеродного сырья;
– для химической промышленности следует применять огромные запасы повсеместно встречающихся карбонатов;
– для энергетики не целесообразно расходовать углерод, связанный в органические ископаемые соединения.
В действительности и энергетика, и химическая промышленность интенсивно потребляют горючие ископаемые – в основном уголь, нефть и газ. Причем получение углеводородов из нефти и газа экономически гораздо более выгодно, чем из угля. Производительность труда в нефтехимии примерно в 12–16 раз выше, чем в химии карбонатов.
Быстрыми темпами растет потребление природного газа. Он используется для производства электроэнергии, и бытовых нужд, а также как сырье для промышленного производства ацетилена, формальдегида, метанола, синильной кислоты, водорода и т. п. Общие ресурсы природного газа оцениваются в 120 000 млрд. м3, из них на территории России обнаружено около 80 000 млрд. м3. При потреблении 1500 млрдм3 в год природного газа, как полагают некоторые ученые, хватит приблизительно на 80 лет. По другим оценкам, истощение природного газа ощутиться гораздо раньше.
На смену нефти и природному газу придет уголь, и лидирующее место займет химия угля. В последние десятилетия разрабатываются эффективные методы переработки угля. В частности, предложен способ эффективного производства моторного топлива из угля, объединяющий энергетические и химические установки. Запасы угля огромны, но ограничены.
Чего же следует ожидать после истощения богатых ресурсов природного газа, нефти и угля? Вероятно большее внимание будет уделяться химии карбонатов. Химические превращения карбонатов станут энергетически приемлемыми. Уже наметились пути уменьшения затрат энергии при их переработке. На стадии разработки находится каталитический метод превращения углекислого газа СО воздуха в простые органические соединения без высоких температур и давления. Не следует забывать о 2 блн т углерода, накопленного в биосфере. Растительный мир Земли можно рассматривать как непрерывно работающие химические фабрики, потребляющие энергию Солнца. При разумном хозяйствовании их продукции может хватить на продолжительный период времени. В этой связи фотосинтез как важнейший природный процесс должен стать объектом пристального внимания все большей массы населения планеты.
Вторичное сырье
Полезные сырьевые запасы Земли при современных темпах их потребления быстро истощаются. Одновременно накапливается огромное количество отходов промышленных предприятий, городов и многочисленных населенных пунктов. Одна из главных задач современных промышленных и хозяйственных предприятий – включить отходы в промышленный цикл, что, естественно, будет способствовать сохранению природных ресурсов.
Среди многообразия вторичного сырья металлы занимают первое место по потреблению. За счет них покрывается существенная доля потребностей промышленности. Для разных целей используется чуть больше половины растительной массы – древесины. Ветки, пни, листья деревьев остаются в лесу, а опилки, стружка чаще всего составляют отходы деревообрабатывающей промышленности. В производстве целлюлозы лишь 1/4 общей биомассы деревьев переходит в конечный продукт, при этом теряется большое количество весьма ценных ароматических соединений. В данной связи одна из важнейших задач потребителей древесины – более эффективная переработка биомасс. Древесина служит сырьем не только для бумажной промышленности, но и для производства строительных и столярных пиломатериалов, белковой массы, активированного угля, множества медикаментов и т. п. Но все-таки относительно большая масса древесины идет на производство бумаги и картона. Отработана технология переработки использованной бумаги и картона, и их утилизация особенно важна: 50 тыс. т макулатуры экономят 120 тыс. м3 древесины и тем самым сберегают 500 га леса. К сожалению, таким ценным вторичным сырьевым материалом часто пренебрегают.
Весомый сырьевой потенциал представляют зола и шлаки, остающиеся после сжигания угля. Лишь незначительное количество таких отходов находят применение, в то время как на их ликвидацию расходуются большие средства. Определенную часть золы, например, можно было бы использовать в качестве наполнителя цемента. Так, 1,3 т золы бурого угля, извлеченной из дымовых газов, заменяет 1 т цемента. Кроме того, такая зола содержит 5–30% окиси железа, около 30% извести и заметное количество коксованного остаточного угля. Железная руда, известь и кокс – это главные сырьевые компоненты для металлургии. Следовательно, большое практическое значение имеет извлечение железа и силикатных строительных материалов из зольного и шлакового вторичного сырья.
Из нефтяных отходов в хозяйственный цикл возвращается 25–35%, хотя уровень повторного их применения может быть гораздо выше.
В настоящее время выпускаются большие объемы пластмассовой продукции. Однако не все виды пластмасс поддаются утилизации. Если полистирол, поливинилхлорид и другие пластмассы успешно возвращаются в промышленность (из них изготавливают различного рода покрытия) то полиуретан и различные искусственные волокна гораздо труднее поддаются переработке.
Сбор и переработка вторичного сырья, конечно, требуют вполне определенных капиталовложений, но следует помнить, что применение некоторых видов вторичного сырья обходится все же дешевле, чем переработка первичного сырья, т. е. сырья, накопленного в течение длительного времени в недрах Земли. Утилизация вторичного сырья, т. е. обеспечение новой жизни старым вещам, предметам и изделиям, – вовсе не признак бедности, а свидетельство, прежде всего, разумного ведения хозяйства в государственном масштабе.
Основную массу природного органического сырья, интенсивно потребляемого для производства тепла, электроэнергии и разнообразной химической продукции, составляют горючие источники: нефть, уголь, природный газ, горючие сланцы, смоляные пески, торф и биомасса. При их химическом превращении – сгорании– выделяется тепловая энергия, которая используется непосредственно для обогревания, например жилых домов и служебных помещений, и для производства электроэнергии. При этом существенную долю, например, нефтепродуктов составляет топливо для транспорта.
Нефть
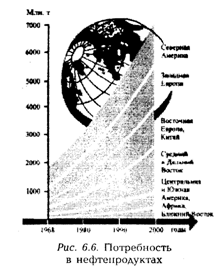
В последние десятилетия потребление нефти в мире постоянно увеличивается. Потребность в нефтепродуктах продолжает возрастать (рис. 6.6). За десятилетний период с 1968 по 1978 гг. нефти было добыто столько же, сколько за предшествующие 110 лет. Значительная ее доля расходуется на производство топлива для различных энергоустановок, в том числе и для транспорта.
Превращение исходного природного продукта – сырой нефти – включает ее добычу, переработку и сжигание. В процессе добычи сырая нефть извлекается из разведанного месторождения.
Добыча нефти осуществляется в три этапа. На первом этапе извлекается 10–30% нефти при естественном давлении из природного резервуара, заполненного сложными образованиями из пористых пород. На втором этапе добычи при накачке воды, газа или пара нефть выталкивается на поверхность, что позволяет получить до 35% разведанных запасов. Извлечение остальной части сырой нефти на третьем этапе требует новых технологических приемов. Наиболее перспективные из них связаны с применением поверхностно-активных веществ и полимерных растворителей для извлечения нефтяных фракций из водной среды. Например, на третьем этапе добычи можно извлечь более 50 млрд. т нефти, содержащейся в разведанных месторождениях только одной страны – США.
Добытая сырая нефть чаще всего представляет собой маслянистую жидкость, состоящую преимущественно из сложной смеси углеводородов-алканов с линейной структурой и, в основном, с одинарными связями. Кроме алканов, нефть содержит разветвленные и циклические углеводороды, а также соединения с одной двойной связью, т. е. алкены, и соединения с бензольными кольцами, относящиеся к ароматическому ряду. Сырая нефть включает компоненты, молекулярная масса которых находится в пределах от значений для природных газов: 14 (метан СН4 ), 30 (этан С2H6), 44 (пропан C3H8) и 58 (бутан С4Н10) – до значения для парафинового воска С30Н62 , равного 422.
Процесс переработки нефти, называемый крекингом, начинается с перегонки, при которой различные компоненты нефти разделяются в соответствии с их температурой кипения. Вначале извлекаются наиболее летучие углеводороды, один из них октан C8H18. По октановому эквиваленту оценивается качество моторного топлива. В процессе переработки удаляются неорганические примеси, включая серу, и в результате каталитического крекинга производится расщепление больших молекул, при котором образуется соединение с более низкой температурой кипения. Для перестройки молекул и формирования их структур с оптимальными характеристиками, в том числе и для повышения октанового числа топлива, применяется каталитический реформинг. Каталитический процесс, таким образом, играет существенную роль при переработке нефти.
Лучшие катализаторы для переработки нефти – дорогостоящие и малораспространенные металлы: платина, палладий, родий и иридий. Например, с помощью катализатора – платины – алканы, приводящие к несинхронному воспламенению топлива в цилиндрах двигателя и вызывающие детонацию, превращаются в углеводороды с лучшими горючими характеристиками и с большим октановым числом. При наличии платинового катализатора и водорода низкооктановый алкан с неразветвленной цепью преобразуется в соединение бензола или циклического алкана с более высоким октановым числом.
Относительно недавно освоены новые каталитические процессы для переработки нефти, которые основаны на применении цеолитовых молекулярных сит (алюмосиликатов), платинорениевого/платино-иридиевого и платина/палладий/родиевого катализаторов. В настоящее время возрастает и особенно в будущем будет возрастать в переработке доля добываемой нефти низкого качества, т.е. нефти с относительно большой концентрацией серы, с более высокомолекулярными компонентами и с различного рода примесями, например, с примесями ванадия, никеля и других элементов, которые затрудняющих процесс катализа. В этой связи технологический цикл переработки нефти необходимо постоянно совершенствовать, чтобы производить высокооктановое топливо, продукты сгорания которого не загрязняли бы окружающую среду.
В последние десятилетия при детальном исследовании процесса горения топлива были выявлены азотнокислые и серосодержащие продукты сгорания, приводящие к кислотным осадкам, а также хлоросодержащие и другие соединения, загрязняющие атмосферу. Как выяснилось, горение – сложный химический процесс, зависящий от многих факторов. Повышение эффективности горения – это один из лучших способов сбережения природных энергоресурсов и сохранения окружающей Среды.
Переработка нефти включает операцию обессоливания и последующее разделение нефти на фракции при различных температурах кипения. Возрастающая потребность в топливе приводит к необходимости переработки нефтяных фракций. Для чего применяется термический крекинг, представляющий собой разложение нефтепродуктов при высокой температуре (выше 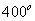 С), при которой получается низкокипящий углеводород – бензин. Перспективен каталитический метод гидрокрекинга (под действием водорода происходит гидрофикация и тем самым отпадает необходимость в дополнительной операции очистки). На современных установках ежегодно вырабатывается более 700 тыс. т нефтепродуктов. Для повышения детонационной стойкости моторное топливо подвергается каталитической обработке при температуре 500° С и давлении 20–40 атм. Нефтехимический синтез базируется на пиролизе парафинов при температуре 800–870° С. С), при которой получается низкокипящий углеводород – бензин. Перспективен каталитический метод гидрокрекинга (под действием водорода происходит гидрофикация и тем самым отпадает необходимость в дополнительной операции очистки). На современных установках ежегодно вырабатывается более 700 тыс. т нефтепродуктов. Для повышения детонационной стойкости моторное топливо подвергается каталитической обработке при температуре 500° С и давлении 20–40 атм. Нефтехимический синтез базируется на пиролизе парафинов при температуре 800–870° С.
В результате переработке нефти получается более двух десятков основных соединений. Наиболее важные из них – олефины, диолефины (этилен, пропилен, бутадиен, изопрен), ароматические соединения (бензол, толуол, ксилол) и газовая смесь оксида углерода с водородом (см. рис. 6.7). На основе данных соединений синтезируется тысячи промежуточных и конечных продуктов. В настоящее время около 90% всех органических соединений производится из нефти и природного газа.
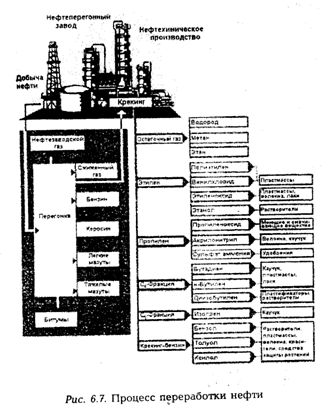
О темпах развития нефтехимии можно судить по росту производства этилена - сырья для получения пластмасс, лаков и красок. За 20 лет (1960- 1980 гг.) объем этилена увеличился более чем в 10 раз (с 3,4 до 50 млн. т). Только для производства различных продуктов без учета топлива в 1975 г. было израсходовано около 100 млн. т нефти.
Вплоть до середины XIX в. нефть использовалась преимущественно как колесная мазь и в лечебных целях. В 1860г. мировая потребность в ней составляла около 70 тыс. т. К концу XIX в. она возросла до 21 млн. т, и через 75 лет - до 2730 млн. т. Разведанные запасы нефти на конец 1974 г. оценивались в 97 млрд. т. К началу 90-х годов XX в. они составили около 600 млрд. т. По некоторым оценкам, к 2000 г. разведанные запасы приблизятся к 800–1000 млрд. т. Предполагается, что запасов нефти хватит до 2050 г. при нынешних темпах потребления.
Уголь
Мировые запасы доступного для разработки угля в 20–40 раз превосходят нефтяные ресурсы. Например, в США угля в 50–100 раз больше, чем нефти. Уголь – наиболее распространенное в природе минеральное топливо, роль которого в ближайшие десятилетия будет расти по мере истощения нефтяных и газовых месторождений. В данной связи будет расти и практическая значимость фундаментальных и прикладных исследований, направленных на разработку эффективных и экологически чистых способов превращения весьма ценного угольного сырья. Экономическая широкомасштабная переработка угля в эффективное топливо позволила бы сохранить нефть для получения из нее многих ценнейших соединений, необходимых для химической промышленности. Нефть как источник многих химических продуктов слишком дорога, и ее использовать в качестве топлива нерационально. С развитием химической технологии уголь станет одним из важнейших источников сырьевых продуктов, в том числе и тех, которые уже в настоящее время получают из нефти (рис. 6.8).
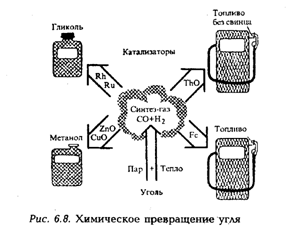
Уголь – твердое горючее, полезное ископаемое растительного происхождения – содержит, кроме углерода и водорода, серу и азот, а также некоторое количество минералов и влаги. Соотношение водород/углерод в угле примерно равно 1, что вдвое меньше, чем в бензине, поэтому как топливо уголь менее эффективен. При химическом превращении угля вначале удаляются из него сера и азот, затем отделяются неорганические примеси и, наконец, уголь превращается в жидкий: синтез-газ, представляющий собой смесь моноксида углерода и водорода.
Применение синтез-газа весьма перспективно, но его производство пока экономически не выгодно. Переработка угля может достигать крупных масштабов. Например, во время второй мировой войны в Германии, лишенной доступа к источникам нефти, в результате переработки угля было получено 585 тыс. т углеводородного топлива. Синтез-газ превращался в моторное топливо с помощью кобальтового катализатора. В недалеком прошлом ЮАР удовлетворяло около 40% своих потребностей в топливе, ежегодно получая 1750 тыс. т углеводорода из угля с применением железного катализатора. Перерабатывающие заводы располагались прямо на угольных залежах, откуда уголь конвейером загружался в химические реакторы.
Природный газ
Один из важнейших источников энергоресурсов – природный газ – представляет собой смесь углеводородов с относительно небольшой молекулярной массой. Состав природного газа весьма разнообразен. Обычно он содержит 60–80% метана, остальное приходится на этан СH4, пропан C3H8 и бутан С4H10, соотношение которых может быть различным. В природном газе есть и примеси, включающие серу, азот и другие элементы. Обычно этан и пропан каталитически превращают в этилен С2Н4, пропилен С3Н6 и ацетилен С2Н2 – ценное сырье для производства разнообразной полезной продукции.
Природный газ легко транспортируется по трубопроводу. В последние десятилетия его потребление резко возросло. Значительная доля мировых ресурсов природного газа принадлежит России. Запасы природного газа в США несколько превосходят запасы нефти. В целом источники природного газа и нефти ограничены и быстро истощаются.
Горючие сланцы, смоляные пески и торф
К одному из видов источников энергоресурсов относятся горючие сланцы – разновидность осадочных горных пород. Из них производят жидкие углеводороды. Например, согласно некоторым оценкам, только в сланцах трех штатов – Колорадо, Юта и Вайоминг содержится около 60 млрд. т углеводородов. Однако для широкомасштабной промышленной добычи горючих сланцев еще предстоит решить сложные химические, геохимические и технологические проблемы.
Горючие сланцы образовались из древних морских отложений ила и различной растительности. Кроме основной минеральной составляющей, они содержат кероген – смесь нерастворимых органических полимеров и небольшое количество битума – смеси органических соединений, растворимых в бензоле. При разработке сланцевых отложений возникает проблема сохранения чистоты водных ресурсов и почвы, так как из тонны сланцев можно извлечь всего лишь 40–160 литров сырой нефти. Соотношение водород/углерод в сланцевом масле составляет около 1,5. Сланцевое масло содержит нежелательные примеси в виде органических соединений азота и серы, а также особо опасные для здоровья человека соединения мышьяка.
Смоляные пески состоят из остаточных асфальтовых фракций нефти. При освоении их залежей смоляных песков возникают те же проблемы, что и при добыче и переработке горючих сланцев. Поэтому смоляные пески, как и горючие сланцы, пока не нашли широкого применения.
К горючим полезным ископаемым относится торф, мировые запасы которого составляет около 500 млрд. т (1990 г.), в том числе свыше 186 млрд т в России. Торф образуется при скоплении остатков растений, подвергшихся неполному разложению в условиях болот, и содержит 50–60% углерода. Используется торф комплексно как топливо, удобрение, теплоизоляционный материал и др. По коллорийности он уступает углю и нефтяному топливу.
Биомасса
Биомасса – один из потенциальных источников энергоресурсов. Из нее в результате жизнедеятельности анаэробных бактерий, называемой анаэробным дыханием, ежегодно в атмосферу выделяется 500–800 млн. т метана, что эквивалентно 0,6–1,0 млн. т высококачественной нефти. Однако практическое применение анаэробных процессов для производства метана как источника энергии из биомассы, включающей различные растительные отходы (древесные отходы, побочные сельскохозяйственные продукты, пищевые отходы и т. п.), сдерживается относительно небольшой их скоростью и высокой чувствительностью к кислотности среды. Применение биомассы как источника углеводородного топлива или химического сырья особенно важно, если учесть, что в составе атмосферы наблюдается повышение концентрации углекислого газа, приводящего к парниковому эффекту. Сжигание биомассы не приводит к существенному нарушению баланса углекислого газа в атмосфере: весь углерод биомассы, превращающийся при ее сгорании в углекислый газ, извлекается из воздуха в процессе роста биомассы. Увеличение содержания углекислого газа в атмосфере за последние десятилетия обусловливается сжиганием чрезвычайно большого количества минерального топлива.
Возможно, в скором будущем в результате специальных операций генной инженерии удастся выращивать растения, пополняющие продовольственные ресурсы и биомассу. Такие растения будут интенсивно расти при повышенном потреблении углекислого газа из атмосферы, что естественно будет сдерживать увеличение углекислого газа в атмосфере.
Древесина
Лесные массивы – не только источник громадных природных энергоресурсов, но и один из основных поставщиков кислорода, необходимого для обеспечения жизнедеятельности чрезвычайно большого множества живых организмов. Лесная древесина – превосходный строительный материал и органическое сырье для производства многих ценных продуктов. Однако к сожалению часто лесные массивы истребляются пожарами и беспощадно вырубаются. Например, в Бразилии ежегодно вырубается около 15 тыс. м3 тропического леса. Во многих странах древесина – один из основных источников тепловой энергии.
Россия – единственная в мире лесопромышленная страна, где занятые под леса площади не уменьшаются, а растут. Причина в том, что за последние годы вырубка леса сократилась у нас почти в пять раз: отдавать древесину даром мы больше не хотим, а покупать ее по мировым ценам прежние потребители не хотят. Речь идет о санкционированной вырубке леса Несанкционированная вырубка леса особенно в последнее десятилетие из-за экономического кризиса в России существенно возросла. Россия теперь не отгружает бесплатно крепежный лес шахтам Донбасса, шпалы железным дорогам Средней Азии и ценные породы дерева мебельным фабрикам Польши и Венгрии. И если такая тенденция сохранится, то площадь российских лесов, составляющая пока чуть больше 1/5 лесного покрытия планеты, может вырасти к 2010г. на 1/3. Вполне возможно, что со временем это принесет России колоссальные доходы.
Леса сегодня, как это не удивительно, в огромных количествах переводятся на дрова, причем даже в наиболее цивилизованных странах. Это происходит в относительно холодной Финляндии, лидирующей в использовании древесины на топливо, и в теплой Франции, где сжигается почти четверть заготовляемой в стране древесины (французы очень любят сидеть у камина!). Но особенно много древесины идет на дрова в бедных странах Азии и Африки, где в сельских районах нередко нет ни газа, ни электричества и дерево – единственный источник тепла для отопления жилища и приготовления пищи. В Бангладеш, например, на топливо используется почти вся добываемая древесина, в результате в самом ближайшем будущем этой стране грозит настоящая катастрофа экологическая и энергетическая катастрофа. Весьма тяжелая ситуация складывается и в Индии, где на дрова переводят более 90% добываемой древесины. Ведь там дрова идут не только на приготовление пищи и на отопление, но и на огромные древесные костры (к тому же, как правило, из ценных пород дерева), в которых по традиции кремируют умерших.
В России, несмотря на суровый климат и отнюдь не повсеместный комфорт, на дрова переводится не более 21% всей древесины, поскольку цены на нее растут, особенно – на лесоматериалы, и еще больше – на те породы дерева, которые идут на производство мебели.
Но главная и постоянно увеличивающаяся ценность лесов – это их способность поглощать углекислоту и выделать кислород. Промышленные выбросы углекислоты от заводов, электростанций и автомобилей уже давно не полностью компенсируются фотосинтезом земной растительности. Накапливаясь в атмосфере, вредные газы не только становятся причинами кислотных осадков и ускоренной коррозии металлов, но и способны вызвать на нашей планете глобальное изменение климата. Грозящее ей потепление чревато заметным поднятием уже в следующем столетии уровня Мирового океана, а следовательно, затоплением миллионов квадратных километров земли и многих десятков городов.
Избежать этой опасности можно разными способами, к примеру, оснащать производства системами, поглощающими углекислоту и вредные газы. Это, однако, очень дорого, тогда как леса очищают воздух бесплатно. Пока бесплатно.
Уже подсчитано, что один га леса поглощает такое количество вредных газов, на техническую очистку от которого надо затратить около трех тысяч долларов. В Организации Объединенных Наций уже выдвигалась идея о необходимости введения налога на углекислоту с тем, чтобы тратить эти средства на сохранение лесов. Однако большинство стран предпочло использовать очистительные способности чужих лесов задаром.
Думается все же, что к системе экологических налогов человечество вынуждено будет придти. Платежи из этого источника позволили бы России быстро выплатить долги всем тем странам, которые на протяжении столетий безрассудно уничтожали свои лесные богатства.
.
Комментарии (3)
Обратно в раздел Наука
|
|
